Une lame de zinc plonge dans un becher 1 contenant une solution de nitrate de zinc.
Une lame d'argent plonge dans un becher 2 contenant une solution de nitrate d'argent.
Un pont salin contenant du nitrate de potassium relie les deux demi-piles. La pile débite dans un circuit. L'équation de fonctionnement est :
Zn(s) + 2Ag+(aq) = 2Ag(s) + Zn2+(aq)
A- La variation de masse de la cathode est négative. faux.
cathode : réduction de l'ion Ag+ en métal Ag.
B- La concentration en anions augmente dans le becher de la demi-pile à l'argent.. faux.
C- L'électrode de zinc, le pôle négatif de la pile, subit une oxydation. vrai.
anode : oxydation Zn --> Zn2+ + 2 électrons.
D- La variation de masse de l'anode est positive.faux.
E- La capacité de cette pile dépend de la quantité initiale d'ions Ag+.vrai.
La constante d'équilibre K de la réaction Zn(s) + 2Ag+(aq) = 2Ag(s) + Zn2+(aq) est : 1 1038,5 ; 1 1052; 1 10-52 ; 1063,5 ; 2 10-38,5.
La réaction d'équation Zn2+(aq) + 2e- = Zn(s) a pour constante K1=1 10 -25.
La réaction d'équation Ag+(aq) + e- = Ag(s) a pour constante K2=1 1013,5.
K1 = [1/[Zn2+]éq ; K2=1/[Ag+]éq ; K = [Zn2+]éq / [Ag+]2éq = K22/K1 =1027/10 -25= 1052.
ester :
Un ester de formule C5H10O2 est hydrolysé suivant deux réactions.
En milieu acide, la réaction ( 1) génère un corps A et un corps B.
En milieu basique, la réaction 2 génère le même corps A et un corps D
A- Le corps A est un alcool. vrai.
B est un acide carboxylique.
B- La réaction 1 est lente et totale. faux.
C- La réaction 2 est lente et limitée. faux.
D- Le corps B se transforme en D en milieu basique. vrai.
acide carboxylique + HO- = ion carboxylate + eau.
E- L'ester E peut se nommer ethanoate de propanoyle. faux.
éthanoate de propyle.
correction
Le raffinage du cuivre s'effectue par électrolyse dite " à anode soluble".
Pour étudier le principe de cette électrolyse, on réalise l'expérience suivante schématisée ci-dessous. Dans un becher de 250 mL contenant une solution aqueuse de sulfate de cuivre ( Cu2+(aq) + SO42-(aq) de concentration molaire volumique égale à 0,1 mol/L acidifiée par de l'acide sulfurique (2H+(aq) + SO42-(aq)), on dispose une électrode de graphite ( inerte chimiquement pour l'électrolyse étudiée) et un fil de cuivre de masse m.
On donne les couples oxydant/réducteur des couples contenus dans l'électrolyseur :
H2O (l) / H2(g) ; O2(g) / H2O (l) ; H+(aq) / H2(g) ; S2O82-(aq)/ SO42-(aq) ; Cu2+(aq)/Cu(s).
La masse molaire du cuivre est 63,5 g/mol ; 1 F= 96 500 C/mol.
On réalise l'électrolyse à intensité I constante. La tension est réglée à 0,30 V. Au bout d'une durée Dt on arrête l'électrolyse, on sort le fil de cuivre de l'électrolyseur, on le sèche et on le pèse : soit m' la masse obtenue, on a m<m'. D'autre part on observe au fond de l'électrolyseur la formations de boues constituées d'impuretés insolubles et enfin, l'électrode de graphite s'est recouverte d'une fine couche de cuivre légérement rosée. Il n'y a pas eu de dégagement gazeux et les ions sulfates ne réagissent pas.
Indiquer par des flèches le sens conventionnel du courant et le sens de déplacement des électrons dans le circuit extérieur. Indiquer le sens de déplacement des anions et des cations.
Identifier en justifiant l'anode et la cathode.
Ecrire pour chaque électrode l'équation de la réaction modélisant la transformation chimique qui s'y produit.
On donne I=1,5 A : calculer la quantité d'électricité Q qui traverse le circuit extérieur pendant Dt = 15 min.
En vous aidant d'un tableau d'avancement décrivant la réaction cathodique, montrer que l'avancement x de cette réaction au bout de la durée Dt est donnée par l'expression : x= n(Cuformé) = IDt/ (2F).
- En déduire la masse de cuivre déposée sur le graphite.
 A la cathode négative, l'oxydant Cu2+ gagne des électrons et se réduit. Cu2+ (aq) +2e- = Cu(s) A l'anode positive, un réducteur ( le métal de l'anode ) s'oxyde en cédant des électrons Cu(s) = Cu2+ (aq) +2e-.
A la cathode négative, l'oxydant Cu2+ gagne des électrons et se réduit. Cu2+ (aq) +2e- = Cu(s) A l'anode positive, un réducteur ( le métal de l'anode ) s'oxyde en cédant des électrons Cu(s) = Cu2+ (aq) +2e-. Quantité d'électricité Q qui traverse le circuit extérieur pendant Dt = 15 min.
Q= IDt = 1,5*15*60 = 1350 C
Tableau d'avancement décrivant la réaction cathodique :
n(e-) = IDt / F = 2x
x= n(Cuformé) = IDt/ (2F).
Masse de cuivre déposée sur le graphite.
masse (g) = quantité de matière (mol) * mase molaire (g/mol)
m =n(Cuformé) M(Cu) =IDt/ (2F) * M(Cu) = 1350*63,5/(2*96500) =0,44 g.
L'acide benzoïque C6H5-COOH est un solide blanc, peu soluble dans l'eau : solubilité à 25 °C s= 2,5 g/L. M= 122 g/mol.
couple acide base : acide benzoïque / ion benzoate : C6H5-COOH / C6H5-COO- pKa = 4,2 à 25°C.
L'acide benzoïque peut être utilisé comme conservateur dans les boissons de type soda.>Ecrire l'équation de la réaction modélisant la transformation chimique qui a lieu lors de la mise en solution de l'acide benzoïque dans l'eau.
- Ecrire l'expression de la constante d'acidité de cet acide.
- Le pH d'une boisson gazeuse contenant de l'acide benzoïque est égal à pH=3,0. Exprimer puis calculer le rapport [ C6H5-COOH ]/[C6H5-COO-] à l'équilibre. Que peut-on en déduire ?
- Pouvait-on prévoir le résultat en raisonnant sur le domaine de prédominance des espèces chimiques du couple C6H5-COOH / C6H5-COO- ?
- Ecrire l'équation de la réaction modélisant la transformation chimique qui a lieu lors du titrage.
- En déduire c1. Le résultat est-il compatible avec la solubilité s ?Le benzoate de benzyle C6H5-COO-CH2-C6H5 est utilisé dans les lotions pour soigner certaines piqures d'insectes. Il peut être synthétisé au laboratoire par action de l'acide benzoïque sur l'alcool benzylique C6H5-CH2-OH.
- Ecrire l'équation de la réaction modélisant la transformation chimique qui a lieu lors de la synthèse.
- Comment appelle t-on cette réaction ? Quelles sont ces caractéristiques ?
Equation de la réaction modélisant la transformation chimique qui a lieu lors de la mise en solution de l'acide benzoïque dans l'eau. C6H5-COOH + H2O = C6H5-COO- + H3O+.
Expression de la constante d'acidité de cet acide.
Ka = [C6H5-COO-][H3O+] / [C6H5-COOH]
Calcul du rapport [ C6H5-COOH ]/[C6H5-COO-] si pH=3 :
[ C6H5-COOH ]/[C6H5-COO-] = [H3O+] / Ka = 10-3 / 10-4,2 = 101,2=15,8.
La forme acide du couple acide base prédomine à pH=3.
Ce résultat était prévisible en raisonnant sur le domaine de prédominance des espèces chimiques du couple C6H5-COOH / C6H5-COO- :
à pH < pKa, la forme acide prédomine.
Equation de la réaction modélisant la transformation chimique qui a lieu lors du titrage : C6H5-COOH (aq)+ HO-(aq) = C6H5-COO- (aq) + H2O.
A l'équivalence V1c1 = V2c2 ;
c1 = V2c2/ V1= 20*0,01/10 = 0,020 mol/L
titre massique en acide benzoïque (g/L) = concentration molaire (mol/L) * masse molaire (g/mol)
0,020*122 = 2,4 g/L, résultat compatible ( inférieure à s) avec la solubilité s ( 2,5 g/L à 25 °C)
Equation de la réaction modélisant la transformation chimique qui a lieu lors de la synthèse : C6H5-COOH + C6H5-CH2-OH = C6H5-COO-CH2-C6H5 + H2O.
estérification, lente, athermique, limitée par l'hydrolyse de l'ester.
correction
correction
Oxydation de l'éthanol en acide éthanoïque.
Texte : la législation autorise l'addition de 5 % ( en volume) d'éthanol à l'essence. Va=20 mL de ce carburant sont oxydés par une solution acidifiée de permanganate de potassium C= 0, 4mol/L .Véquivalent = 24 mL. réthanaol = 790 kg m-3. C : 12 ; H : 1 ; O : 16 g/mol
Couples Ox/red : CH3COOH/CH3CH2OH et MnO4-/Mn2+.
Questions traitant de la quantité de matière d'alcool exprimée en mole, en gramme ou en mL.
Analyse :
Il faut écrire les demi-équations électroniques puis l'équation bilan.
5 fois { CH3CH2OH +H2O = 4H+ + 4e- + CH3COOH }
4 fois { MnO4- + 8H+ + 5e- = Mn2+ + 4 H2O }
5 CH3CH2OH + 4 MnO4- + 12H+ = 5 CH3COOH + 4 Mn2+ + 11 H2O .
d'où à l'équivalence : n(alcool) = 5/4 n( MnO4- ) = 1,25 n( MnO4- ).
Une quantité de matière (mol) est égal au volume (L) multipliée par la concentration (mol/L)
n(MnO4-) =C Véquivalent =0,4* 24 10-3 = 9,6 10-3 mol.
n(alcool) = 1,25 * 9,6 10-3 = 0,012 mol ; n(alcool) = 12 mmol.
Une concentration (mol/L) est une quantité de matière (mol) divisée par un volume (L).
[alcool] = n(alcool) / Va = 0,012/0,020 = 12/20 ; [alcool] = 0,6 mol/L.
Masse (g) d'alcool dans 1 L = quantité de matière (mol) * masse molaire (g/mol)
M = 12*2+6+16 = 46 g/mol ; m(alcool) = 0,6*46 = 27,6 g dans 1 L.
volume ( mL) = masse ( g) divisée par la masse volumique ( g/mL).
790 kg m-3 = 790 *103 / 106 g/cm3 = 0,79 g/cm3 = 0,79 g/mL.
1 mL a une masse de 0,79 g
V mL ont une masse de 27,6 g
d'où le volume d'alcool : 27,6 / 0,79 = 35 mL dans 1 L de carburant
pourcentage volumique : 35/1000 *100 = 3,5 %.
a) exact : après l'équivalence l'ion permanganate de couleur violette est en excès.
Seules les affirmations contenant l'une des informations suivantes sont donc exactes :
Quelle est la couleur de la solution avant, pendant, après l'équivalence? Seul l'ion permanganate MnO4- est coloré ( violet assez foncé)
La burette contient la solution de permanganate de potassium ; l'erlenmeyer ou le becher contient la solution avec l'éthanol.
Avant l'équivalence : MnO4- est en défaut dans le becher, la solution est donc incolore.
A l'équivalence : MnO4- ajouté est en quantité stoechiomètrique, la solution est incolore.
Après l'équivalence : MnO4- est en excès dans le becher, la solution est donc rose violet.
Seule l' affirmation suivante est donc exacte :
En ajoutant une goutte de solution de permanganate après l'équivalence, la couleur de la solution change.
Texte : à partir de 80 g de ce mélange on obtient un produit unique, l'acide éthanoïque de masse m. Le volume de la solution obtenue, notée S, est 1 L. On titre 10 mL de la solution S par de la soude (hydroxyde de sodium) de concentration CB= 1,0 mol/L.Véq = 18,0 mL. C = 12 ; H= 1 ; O= 16 g/mol. Couples acide / base : H2O / HO- ; CH3-COOH / CH3-COO-. Analyse : Questions traitant des quantité de matière d'alcool et d'aldehyde exprimées en mole, en masse. On note a, la quantité de matière d'éthanol et b celle d'éthanal. M( C2H6O, alcool) = 46 g/mol ; M( C2H4O éthanal) = 44 g/mol. masse du mélange = masse éthanol + masse éthanal . masse (g) = masse molaire (g/mol) * quantité de matière (mol) m( éthanol )= 46 a ; m( éthanal) = 44 b. 80 = 46 a + 44 b (1) Couples oxydant / réducteur : CH3-COOH / CH3-CH2-OH et CH3-COOH / CH3-CHO. CH3-CH2-OH +H2O = CH3-COOH + 4H+ + 4e-. Par oxydation ménagée, a mol d'éthanol donne a mol d'acide éthanoïque. CH3-CHO +H2O = CH3-COOH + 2H+ + 2e-. b mol d'éthanal donne b mole d'acide éthanoïque. Couples acide / base : H2O / HO- ; CH3-COOH / CH3-COO-. Equation de la réaction de titrage : CH3-COOH + HO- = CH3-COO- + H2O. La quantité de matière totale d'acide éthanoïque est déterminée par les données à l'équivalence du dosage : n( acide) = n ( soude) = c Véq = 1*17,5 10-3 = 1,75 10-2 mol dans 10 mL de la prise soit 1,75 mol dans 1000 mL ou 1 L. Par suite : a+b = 1,75 (2) a = 1,75 -b, repport dans (1) : 80 = 46(1,75-b) + 44 b b = 0,25 mol d'éthanal ; a = 1,5 mol d'éthanol ; m(éthanal) = 44*0,25 = 11 g ; m ( éthanol) = 46*1,5 = 69 g. Seules les affirmations contenant l'une des informations suivantes sont donc exactes : | |||||||||||||
Ion manganate MnO42- et ion permanganate MnO4-. Texte : une solution, notée A, de manganate de potassium est de couleur verte ; une solution, notée B, de permanganate de potassium est de couleur rose violet.
Analyse :
Questions relatives aux mots " oxydation, réduction, oxydant, réducteur, dismutation".
Remarques : le mot "amphotère" ou ampholyte" est réservé aux couples acide / base.
L'ion manganèse Mn2+ est incolore.
" la teinte verte disparaît, une coloration rose apparaît " signifie :
MnO42- , un réducteur, s'oxyde en MnO4- ; la réaction est une oxydation.
4 fois { MnO42- = MnO4- + e- }. MnO42- libère 1 électron.
Or une réduction accompagne toujours une oxydation.
MnO42- , un oxydant, se réduit en Mn2+ ; la réaction est une réduction.
MnO42- +8H+ + 4e- = Mn2+ + 4H2O. MnO42- gagne 4 électrons.
Bilan : 5 MnO42- +8H+ = 4MnO4- + Mn2+ + 4H2O
MnO42- joue un double rôle, oxydant et réducteur ; MnO42- se dismute : la réaction est une dismutation.
Seules les affirmations contenant l'une des informations ci-dessus seraient exactes.
acide oxalique H2C2O4 et ion permanganate MnO4-.
Analyse : 2 fois { MnO4- + 8H+ + 5e- = Mn2+ + 4 H2O } L'oxydant MnO4- se réduit.
5 fois { H2C2O4 = 2 CO2 + 2H+ + 2e-} Le réducteur H2C2O4 s'oxyde.
5H2C2O4 + 2MnO4- + 6H+ = 10 CO2 + 2Mn2++ 8H2O.
Questions relatives aux mots " réactif en excès, en défaut, stoechiométrique".
Quantité de matière (mol) = concentration (mol/L) * volume (L).
Au départ : n(MnO4- ) =CV = 0,10*0,02 = 2 10-3 mol et n(H2C2O4 ) = CaV = 0,25*0,02 = 5 10-3 mol
Donc réactifs en proprotions stoechiométriques.
Questions relatives à l'évolution de la couleur.
Seul l'ion permanganate est coloré ( violet).
A la fin de la réaction, l'ion permanganate est entièrement consommé : la teinte violette s'atténue lentement jusqu'à disparaître.
Questions relatives à la vitesse de la réaction.
Concentrations des réactifs et température sont des facteurs cinétiques.
Le temps de demi-réaction t½ : à t½ l'avancement est égal à la moitié de l'avancement final.
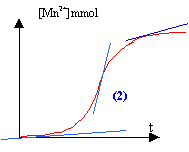
L'ion Mn2+ sert de catalyseur ( autocatalyse) et au début la quantité de catalyseur est nulle.
La tangente est pratiquement horizontale : la vitesse est quasiment nulle.
La quantité de matière d'ion Mn2+ augmente et en conséquence la vitesse de la réaction.
La quantité de matière des réactifs diminue au cours du temps : ce second facteur va faire décroître la vitesse de la réaction au bout d'un temps assez long.
Ce phénomène porte le nom d'autocatalyse : l'un des produits de la réaction sert de catalyseur.
